納豆の持つナットウキナーゼがSARS-CoV-2のスパイク蛋白を分解することがわかった
概要
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によるコロナウイルス感染症2019(COVID-19)がパンデミックとして発生し、世界各国の国民生活や経済に甚大な被害を与えている。しかし、SARS-CoV-2に対する治療薬は未だ不明です。SARS-CoV-2はスパイクタンパク質(Sタンパク質)を持っており、ウイルスの侵入にはSタンパク質の切断が必須である。ナットウキナーゼはBacillus subtilis var. nattoによって生産され、人間の健康に有益である。本研究では、SARS-CoV-2のSタンパク質に対するナットウキナーゼの効果を検討した。Sタンパク質を導入した細胞ライセートをナットウキナーゼとインキュベートしたところ、Sタンパク質は用量および時間依存的に分解された。免疫蛍光分析により、ナットウキナーゼを培養液に添加すると、細胞表面のSタンパク質が分解されることが示された。このことから、ナットウキナーゼはSタンパク質の分解を介してSARS-CoV-2の感染を抑制する可能性があることが示唆された。
はじめに
重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)によるコロナウイルス病2019(COVID-19)が世界的に流行しています。COVID-19のパンデミックは、4億3700万人以上が感染し、630万人以上が死亡した(https://covid19.who.int/、2022年7月4日にアクセス)。SARS-CoV-2の宿主細胞への侵入は、膜貫通型のスパイクタンパク質(Sタンパク質)が媒介し、ウイルスエンベロープから伸びるホモトライマーを形成しています。Sタンパク質は、膜貫通型セリンタンパク質2(TMPRSS2)、カテプシン、フリンなどの細胞内プロテアーゼによって処理され、活性化される。SARS-CoV-2のS1サブユニットは、宿主細胞の受容体であるアンジオテンシン変換酵素2(ACE2)と相互作用してウイルス受容体と結合し、S2サブユニットはウイルスが標的細胞と融合してウイルスの侵入を可能にします[1]。S1サブユニット中の受容体結合ドメイン(RBD)がACE2との結合を担っている。Sタンパク質は、S1サブユニットとS2サブユニットの境界で切断される。
現在、SARS-CoV-2感染防御のためのワクチン開発が各国で進められており、SARS-CoV-2感染者数は減少している。しかし、SARS-CoV-2には、ワクチン標的エピトープが変異した株を含む多数の亜種が報告されている[2,3]。ワクチン接種後にCOVID-19を発症する患者が増加していることから,ワクチン接種によってSARS-CoV-2感染を完全に防ぐことができない可能性がある.したがって、SARS-CoV-2感染に対する新しい治療法を開発することが重要である。
納豆は、大豆をBacillus subtilis var.nattoによって発酵させた日本の伝統的な食品として知られています。ナットウキナーゼは納豆に含まれ[4]、枯草菌が生産する最も重要な細胞外酵素の1つです[5]。ナットウキナーゼは275個のアミノ酸から成り、約28 kDaである[6,7]。ナットウキナーゼはプラスミノーゲンアクチベーターインヒビター-1を不活性化し、線維素溶解を増加させる[8]。また、フィブリノーゲン、第VII因子、サイトカイン、第VIII因子の血漿レベルを低下させます[9]。ナットウキナーゼは、天然に知られる抗凝固剤の中で最も高い血栓溶解能力を有しています[10]。臨床試験では、ナットウキナーゼの経口摂取はいかなる副作用とも関連しないことが実証されました[11]。このように、ナットウキナーゼは現在、効率的で安全、かつ経済的な酵素として、血栓溶解薬の研究において中心的な注目を集めています[12,13]。さらに、ナットウキナーゼはいくつかの腫瘍の治療にも使用されています[14,15]。
最近の研究では、納豆エキスが牛ヘルペスウイルス1(BHV-1)とSARS-CoV-2感染を阻害することが明らかにされました[16]。これらの結果は、納豆抽出物プロテアーゼがSARS-CoV-2感染に対して有効である可能性を示している。本研究では、納豆エキスによるSARS-CoV-2感染阻害が、B. subtilis var. natto由来のナットウキナーゼによるものかどうかを調べることを目的とした。
結果および考察
2.1. SARS-CoV-2のスパイクタンパク質に対するナットウキナーゼの分解効果 in vitro
まず、納豆エキス中のナットウキナーゼがSARS-CoV-2のSタンパク質を分解するかどうかを調べた。SARS-CoV-2のSタンパク質は、感染初期に宿主細胞のACE2受容体に作用して重要な役割を果たす[17]。S タンパク質発現細胞ライセートとナットウキナーゼの 4 倍希釈系列(32 µg/mL, 8 µg/mL, 2 µg/mL, 500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mL)を混合した後、ウェスタンブロッティングを実施した。
Sタンパク質発現細胞溶解液を、ナットウキナーゼ濃度500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mLでD-PBSとインキュベートすると、Sタンパク質(S1およびS2サブユニット)の完全長およびS2サブユニットがバンドとして現れた(図1A)。次に、ナットウキナーゼが時間依存的にSタンパク質を分解するかどうかを検討した。
次に、ライセートを1 µg/mL のナットウキナーゼと10-180分間インキュベートした。SARS-CoV-2のSタンパク質は60-180分のインキュベーションでナットウキナーゼにより分解されたが、10分と30分のインキュベーションでは分解されなかった(図1B)。このように、ナットウキナーゼは用量および時間に依存した方法でSタンパク質を分解した。
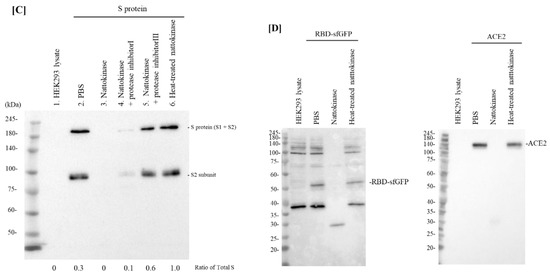
図 1. (A) ナットウキナーゼの用量依存的な分解作用。連続希釈したナットウキナーゼ(32 µg/mL, 8 µg/mL, 2 µg/mL, 500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mL)とSタンパク質発現細胞ライゼットを混合してインキュベーションした。Sタンパク質全長(S1サブユニット、S2サブユニット)とS2サブユニットがそれぞれ上下のバンドとして検出された。総Sの比率は、Sタンパク質(Sタンパク質+S2タンパク質)の相対量として示した。(B) ナットウキナーゼの時間依存的な分解作用。Sタンパク質発現細胞溶解液を1μg/mLナットウキナーゼと0、10、30、60、120、180分間インキュベートした。 C)加熱処理またはプロテアーゼ阻害剤の影響。レーン1:HEK293ライセート、レーン2:HEK293ライセート(1μg/mL)。HEK293ライセート(Sタンパク質);レーン3: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL); レーン4: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL) + プロテアーゼインヒビターI; レーン 5: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL) + プロテアーゼインヒビター III; レーン 6: HEK293 (S protein) + 熱処理したナットウキナーゼ (5 µg/mL)。(D)Sタンパク質とACE2のRBDに対する分解効果。Sタンパク質のRBDおよびACE2コーディングプラスミドを、それぞれHEK293細胞にトランスフェクトした。細胞溶解液は、ナットウキナーゼ(7.5 µg/mL)と熱処理したナットウキナーゼ(7.5 µg/mL)とインキュベートし、ウェスタンブロッティングを実施した。
ナットウキナーゼの分解効果が酵素活性によるものかどうかを確認するため、ナットウキナーゼを加熱処理またはプロテアーゼ阻害剤カクテルで処理した。ナットウキナーゼを100℃で5分間加熱すると、ナットウキナーゼの分解作用は失われた(図1C、レーン6)。さらに、プロテアーゼ阻害剤を加えると、ナットウキナーゼによるSタンパク質バンドの消失はブロックされた(図1C、レーン4および5)。タンパク質阻害剤カクテルIと比較して、AEBSF HCl (4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride)、不可逆的セリンプロテアーゼ阻害剤であるアプロチニン、システインプロテアーゼであるロイペプチンからなるタンパク質カクテルIIIは明らかにナットウキナーゼ活性をブロックしていることが確認された。ナットウキナーゼは、セリンプロテアーゼのサブチリシンファミリーに属するSer-His-Asp (Asp32, His64, Ser221) という同じ保存アミノ酸を持つ[6,18]。ナットウキナーゼの結晶構造は、B. subtilis DB104 由来の subtilisin E とほぼ同じである[19]。この結果は、ナットウキナーゼがセリンプロテアーゼであるという既報の結果と一致する。また、RBDとACE2を発現する細胞ライセートを用いて、ナットウキナーゼの分解作用を評価した。7.5 µg/mLのナットウキナーゼと細胞ライセートをインキュベートしたところ、RBDとACE2のバンドが消失した(図1D)。
2.2. トランスフェクトされた細胞表面上のSARS-CoV-2のスパイクタンパク質に対するナットウキナーゼの分解効果
次に、ナットウキナーゼがトランスフェクションされた細胞表面のSタンパク質を分解するかどうかを検討した。Sタンパク質をHEK293細胞にトランスフェクションした。トランスフェクトした細胞をナットウキナーゼと9時間インキュベートした。細胞表面のSタンパク質は、細胞を透過させずに抗Sタンパク質抗体を用いて検出された(図2A)。Sタンパク質は、トランスフェクションした細胞で検出された。トランスフェクトした細胞をナットウキナーゼで処理すると、細胞表面のSタンパク質は減少した。25 µg/mL および 2.5 µg/mL のナットウキナーゼで細胞を処理すると、Sタンパク質陽性領域と核陽性領域の比率はそれぞれ約0.3および0.7に減少した(図2B)。ナットウキナーゼの分解作用は、細胞毒性がない場合に観察された(図2C)。ウェスタンブロット分析により、総Sタンパク質の量はナットウキナーゼ処理とコントロール処理の間で変化しなかった(補足図;図S1)。これらの結果は、ナットウキナーゼが無毒性濃度域でSARS-CoV-2のSタンパク質を分解することを示す。
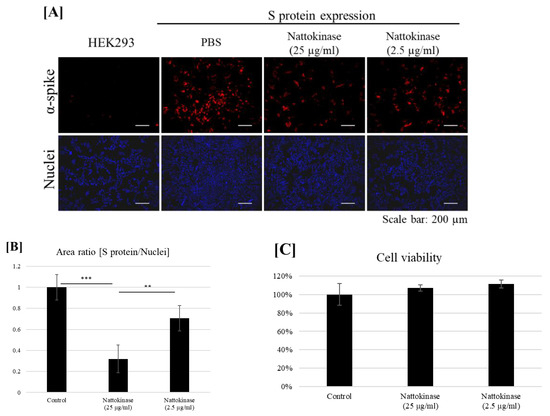
図2 (A) 細胞表面のSタンパク質に対するナットウキナーゼの分解効果。HEK293細胞にスパイクpcDNA3.1をトランスフェクトし、9時間培養した後、培養液にナットウキナーゼ(25および2.5μg/mL)を加えてさらに13時間培養し、細胞を固定し免疫蛍光分析を行った。細胞表面のSタンパク質は抗スパイクタンパク質抗体で染色し(赤)、核はDAPIで染色した(青)。(B) 核陽性領域に対するSタンパク質領域の比率。1サンプルにつき3枚の画像を取り込み、Sタンパク質/核陽性面積を算出した。データは平均+SDで示し、p値はRソフトウェア(R-3.3.3 for windows)を用いてTukeyのポストホックテストを伴う一元配置分散分析(ANOVA)により求めた(** p < 0.01; *** p < 0.001 )。(C)細胞生存率はMTTアッセイで評価した。表示されたナットウキナーゼを培養液に添加し、13時間インキュベートした;MTTアッセイを実施した。
本研究では、ナットウキナーゼのプロテアーゼ活性がSタンパク質の分解に寄与していることを明らかにした。ナットウキナーゼはSタンパク質だけでなく、宿主細胞中のACE2も分解する作用がある。ナットウキナーゼを細胞ライセートと混合したin-vitro評価では、ハウスキーピングタンパク質であるGAPDHも同時に分解されたことから、ナットウキナーゼのタンパク質特異性は低いと考えられる(補足図;図S2)。一方、細胞に添加した場合は、細胞生存率への影響は見られず、細胞表面での保護剤として作用することが期待される。タンパク質分解効果を理解するためには、ナットウキナーゼの分解産物を質量分析計を用いてさらに解析する必要がある。
ナットウキナーゼはSARS-CoV-2のSタンパク質に対する強力な分解活性を持ち、また抗動脈硬化、脂質低下、降圧、抗血栓、線溶、神経保護、抗血小板、抗凝固作用を発揮することが示されている [20]. 高血圧や心血管系の合併症を持つ患者は、COVID-19によって容易に重症化する可能性があります[21]。ワクチン標的エピトープが変異した株を含む多数のSARS-CoV-2の変種が出現しているため、ワクチン接種だけではSARS-CoV-2感染から完全に保護できない可能性があります。ナットウキナーゼと納豆抽出物は、COVID-19 の予防と治療のための新世代の薬剤として開発される可能性を持っている。
ここまで。以下略
以上はInDeep翻訳を利用しました。
まず、納豆エキス中のナットウキナーゼがSARS-CoV-2のSタンパク質を分解するかどうかを調べた。SARS-CoV-2のSタンパク質は、感染初期に宿主細胞のACE2受容体に作用して重要な役割を果たす[17]。S タンパク質発現細胞ライセートとナットウキナーゼの 4 倍希釈系列(32 µg/mL, 8 µg/mL, 2 µg/mL, 500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mL)を混合した後、ウェスタンブロッティングを実施した。
Sタンパク質発現細胞溶解液を、ナットウキナーゼ濃度500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mLでD-PBSとインキュベートすると、Sタンパク質(S1およびS2サブユニット)の完全長およびS2サブユニットがバンドとして現れた(図1A)。次に、ナットウキナーゼが時間依存的にSタンパク質を分解するかどうかを検討した。
次に、ライセートを1 µg/mL のナットウキナーゼと10-180分間インキュベートした。SARS-CoV-2のSタンパク質は60-180分のインキュベーションでナットウキナーゼにより分解されたが、10分と30分のインキュベーションでは分解されなかった(図1B)。このように、ナットウキナーゼは用量および時間に依存した方法でSタンパク質を分解した。

図 1. (A) ナットウキナーゼの用量依存的な分解作用。連続希釈したナットウキナーゼ(32 µg/mL, 8 µg/mL, 2 µg/mL, 500 ng/mL, 125 ng/mL, 31.25 ng/mL, 7.8125 ng/mL)とSタンパク質発現細胞ライゼットを混合してインキュベーションした。Sタンパク質全長(S1サブユニット、S2サブユニット)とS2サブユニットがそれぞれ上下のバンドとして検出された。総Sの比率は、Sタンパク質(Sタンパク質+S2タンパク質)の相対量として示した。(B) ナットウキナーゼの時間依存的な分解作用。Sタンパク質発現細胞溶解液を1μg/mLナットウキナーゼと0、10、30、60、120、180分間インキュベートした。 C)加熱処理またはプロテアーゼ阻害剤の影響。レーン1:HEK293ライセート、レーン2:HEK293ライセート(1μg/mL)。HEK293ライセート(Sタンパク質);レーン3: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL); レーン4: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL) + プロテアーゼインヒビターI; レーン 5: HEK293 (S protein) + ナットウキナーゼ (5 µg/mL) + プロテアーゼインヒビター III; レーン 6: HEK293 (S protein) + 熱処理したナットウキナーゼ (5 µg/mL)。(D)Sタンパク質とACE2のRBDに対する分解効果。Sタンパク質のRBDおよびACE2コーディングプラスミドを、それぞれHEK293細胞にトランスフェクトした。細胞溶解液は、ナットウキナーゼ(7.5 µg/mL)と熱処理したナットウキナーゼ(7.5 µg/mL)とインキュベートし、ウェスタンブロッティングを実施した。
ナットウキナーゼの分解効果が酵素活性によるものかどうかを確認するため、ナットウキナーゼを加熱処理またはプロテアーゼ阻害剤カクテルで処理した。ナットウキナーゼを100℃で5分間加熱すると、ナットウキナーゼの分解作用は失われた(図1C、レーン6)。さらに、プロテアーゼ阻害剤を加えると、ナットウキナーゼによるSタンパク質バンドの消失はブロックされた(図1C、レーン4および5)。タンパク質阻害剤カクテルIと比較して、AEBSF HCl (4-(2-Aminoethyl) benzenesulfonyl fluoride hydrochloride)、不可逆的セリンプロテアーゼ阻害剤であるアプロチニン、システインプロテアーゼであるロイペプチンからなるタンパク質カクテルIIIは明らかにナットウキナーゼ活性をブロックしていることが確認された。ナットウキナーゼは、セリンプロテアーゼのサブチリシンファミリーに属するSer-His-Asp (Asp32, His64, Ser221) という同じ保存アミノ酸を持つ[6,18]。ナットウキナーゼの結晶構造は、B. subtilis DB104 由来の subtilisin E とほぼ同じである[19]。この結果は、ナットウキナーゼがセリンプロテアーゼであるという既報の結果と一致する。また、RBDとACE2を発現する細胞ライセートを用いて、ナットウキナーゼの分解作用を評価した。7.5 µg/mLのナットウキナーゼと細胞ライセートをインキュベートしたところ、RBDとACE2のバンドが消失した(図1D)。
2.2. トランスフェクトされた細胞表面上のSARS-CoV-2のスパイクタンパク質に対するナットウキナーゼの分解効果
次に、ナットウキナーゼがトランスフェクションされた細胞表面のSタンパク質を分解するかどうかを検討した。Sタンパク質をHEK293細胞にトランスフェクションした。トランスフェクトした細胞をナットウキナーゼと9時間インキュベートした。細胞表面のSタンパク質は、細胞を透過させずに抗Sタンパク質抗体を用いて検出された(図2A)。Sタンパク質は、トランスフェクションした細胞で検出された。トランスフェクトした細胞をナットウキナーゼで処理すると、細胞表面のSタンパク質は減少した。25 µg/mL および 2.5 µg/mL のナットウキナーゼで細胞を処理すると、Sタンパク質陽性領域と核陽性領域の比率はそれぞれ約0.3および0.7に減少した(図2B)。ナットウキナーゼの分解作用は、細胞毒性がない場合に観察された(図2C)。ウェスタンブロット分析により、総Sタンパク質の量はナットウキナーゼ処理とコントロール処理の間で変化しなかった(補足図;図S1)。これらの結果は、ナットウキナーゼが無毒性濃度域でSARS-CoV-2のSタンパク質を分解することを示す。

図2 (A) 細胞表面のSタンパク質に対するナットウキナーゼの分解効果。HEK293細胞にスパイクpcDNA3.1をトランスフェクトし、9時間培養した後、培養液にナットウキナーゼ(25および2.5μg/mL)を加えてさらに13時間培養し、細胞を固定し免疫蛍光分析を行った。細胞表面のSタンパク質は抗スパイクタンパク質抗体で染色し(赤)、核はDAPIで染色した(青)。(B) 核陽性領域に対するSタンパク質領域の比率。1サンプルにつき3枚の画像を取り込み、Sタンパク質/核陽性面積を算出した。データは平均+SDで示し、p値はRソフトウェア(R-3.3.3 for windows)を用いてTukeyのポストホックテストを伴う一元配置分散分析(ANOVA)により求めた(** p < 0.01; *** p < 0.001 )。(C)細胞生存率はMTTアッセイで評価した。表示されたナットウキナーゼを培養液に添加し、13時間インキュベートした;MTTアッセイを実施した。
本研究では、ナットウキナーゼのプロテアーゼ活性がSタンパク質の分解に寄与していることを明らかにした。ナットウキナーゼはSタンパク質だけでなく、宿主細胞中のACE2も分解する作用がある。ナットウキナーゼを細胞ライセートと混合したin-vitro評価では、ハウスキーピングタンパク質であるGAPDHも同時に分解されたことから、ナットウキナーゼのタンパク質特異性は低いと考えられる(補足図;図S2)。一方、細胞に添加した場合は、細胞生存率への影響は見られず、細胞表面での保護剤として作用することが期待される。タンパク質分解効果を理解するためには、ナットウキナーゼの分解産物を質量分析計を用いてさらに解析する必要がある。
ナットウキナーゼはSARS-CoV-2のSタンパク質に対する強力な分解活性を持ち、また抗動脈硬化、脂質低下、降圧、抗血栓、線溶、神経保護、抗血小板、抗凝固作用を発揮することが示されている [20]. 高血圧や心血管系の合併症を持つ患者は、COVID-19によって容易に重症化する可能性があります[21]。ワクチン標的エピトープが変異した株を含む多数のSARS-CoV-2の変種が出現しているため、ワクチン接種だけではSARS-CoV-2感染から完全に保護できない可能性があります。ナットウキナーゼと納豆抽出物は、COVID-19 の予防と治療のための新世代の薬剤として開発される可能性を持っている。
ここまで。以下略
以上はInDeep翻訳を利用しました。
マイコメント
私はほぼ毎日の食卓に納豆を取り入れています。
当地域でワクチン接種を4回も受けながら他地域に見られるほど後遺症が見られないのは
もしかしたら納豆を食べているかもしれないと思うのです。
そして、納豆以外の発酵性食品がおそらくワクチンの毒消しに役に立っているのだろうと
思います。
みなさんもこうした味噌・醤油・納豆・漬物(実際に漬けたもの)を食生活に取り入れる
ようにするといいと思います。




コメント