ファイザー コロナワクチン 日本で承認申請 早ければ2月に結論

アメリカの製薬大手ファイザーは、新型コロナウイルスのワクチンの日本国内での使用に向け、18日厚生労働省に承認を求める申請を行いました。新型コロナウイルスのワクチンをめぐって、国内で承認申請が行われるのは初めてで、早ければ2月中にも承認するかどうか結論が出る見通しです。

ファイザーはドイツの企業と共同で新型コロナウイルスのワクチンを開発し、アメリカやイギリスなどでは今月から接種が始まりました。
日本政府も来年6月末までに6000万人分の供給を受けることで基本合意しています。
ファイザーによりますと、これまでに世界各国で行った臨床試験の最終的な効果の分析では95%の有効性が見られ、人種による目立った違いは確認されなかったということです。
このため、ファイザーは、18日、日本国内での使用に向け、厚生労働省に承認の申請を行いました。
国内で新型コロナウイルスのワクチンの承認申請が行われるのは初めてで、審査の手続きを大幅に簡略化する「特例承認」の適用を目指しているということです。
日本政府も来年6月末までに6000万人分の供給を受けることで基本合意しています。
ファイザーによりますと、これまでに世界各国で行った臨床試験の最終的な効果の分析では95%の有効性が見られ、人種による目立った違いは確認されなかったということです。
このため、ファイザーは、18日、日本国内での使用に向け、厚生労働省に承認の申請を行いました。
国内で新型コロナウイルスのワクチンの承認申請が行われるのは初めてで、審査の手続きを大幅に簡略化する「特例承認」の適用を目指しているということです。

ファイザーは国内で実施している臨床試験のデータを来年2月までにまとめる計画で、厚生労働省はこうしたデータを踏まえて有効性や安全性を速やかに審査することにしています。
早ければ2月中にも、承認するかどうか結論が出る見通しです。
早ければ2月中にも、承認するかどうか結論が出る見通しです。
「特例承認」とは
厚生労働省によりますと、「特例承認」は、通常、1年程度かかる医薬品の審査の手続きを大幅に簡略化して早期に承認する制度です。
適用するには、
▽病気のまん延を防ぐために緊急に使用する必要があること、
▽代わりの医薬品がないこと、それに
▽アメリカやイギリスなど日本と同じ水準の承認制度がある国で承認されていることなどをすべて満たすことが条件になります。
2009年に新型インフルエンザが流行した際に初めて適用され、2種類のワクチンが申請からおよそ3か月で承認されました。
また、ことし5月には新型コロナウイルス治療薬の「レムデシビル」に適用され、申請から3日で承認されています。
適用するには、
▽病気のまん延を防ぐために緊急に使用する必要があること、
▽代わりの医薬品がないこと、それに
▽アメリカやイギリスなど日本と同じ水準の承認制度がある国で承認されていることなどをすべて満たすことが条件になります。
2009年に新型インフルエンザが流行した際に初めて適用され、2種類のワクチンが申請からおよそ3か月で承認されました。
また、ことし5月には新型コロナウイルス治療薬の「レムデシビル」に適用され、申請から3日で承認されています。
ファイザー日本法人「速やかに届けたい」
ファイザーの日本法人は、「このたびの申請は科学的に厳格で高い倫理に基づく研究開発から得られたデータに基づいており、承認が得られた際は速やかに日本の皆様にもワクチンをお届けし、社会生活正常化の一助として貢献してまいります」とコメントしています。
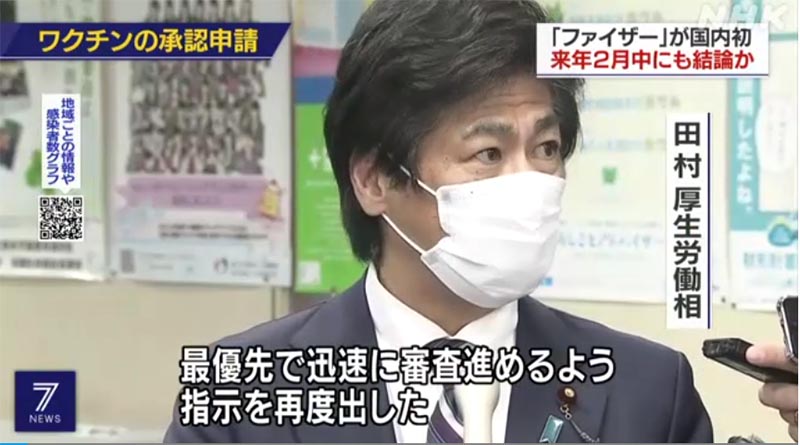
田村厚生労働相「最優先で審査」

田村厚生労働大臣は、記者会見で「有効性や安全性をしっかりと審査した上で判断していく。アメリカでは緊急使用許可が出たという話もある中、わが国としてどうするかは、しっかりとデータを見た上でとなる。最優先の課題なので、最優先で審査をしていく」と述べました。
一方で副反応が懸念されていることについて、「接種が始まっている海外の情報をしっかり収集し、審査の中の1つのデータとして分析していきたい。ワクチン全般において、すごくまれにアレルギー反応はあるわけなので、そういうことも踏まえて、しっかり審査をしていく」と述べました。
一方で副反応が懸念されていることについて、「接種が始まっている海外の情報をしっかり収集し、審査の中の1つのデータとして分析していきたい。ワクチン全般において、すごくまれにアレルギー反応はあるわけなので、そういうことも踏まえて、しっかり審査をしていく」と述べました。
ワクチンの安全性・有効性 どう評価

ファイザーは、日本国内でも160人を対象に免疫の働きや安全性を確認する初期段階の臨床試験を進めていますが、今回の承認申請は、国内で医薬品の審査を行うPMDA=医薬品医療機器総合機構と相談した上で、海外での大規模な臨床試験の結果をもとに行ったということです。
PMDAはことし9月、新型コロナウイルスのワクチンを審査する際の考え方を公表しています。
それによりますと、有効性を評価するために、
▼ウイルスを攻撃する抗体ができることを確認するだけでなく、ウイルスを排除する免疫の細胞の働きについても解析することを求めています。
その上で
▼臨床試験で、ワクチンを投与するグループとワクチンに似せた偽の薬、「偽薬」を投与するグループに分けて比較することで、発症を予防する効果があるかなどを確認する必要があるとしています。
また、安全性については、
▼臨床試験でワクチンを投与してから少なくとも7日目までと28日目までに体に異常が出ないか確認することや、
▼投与後少なくとも1年間は健康状態の確認を続けることなどが必要だとしています。
一方で、海外で大規模な臨床試験が行われ、予防効果が確認されているワクチンについては、国内での臨床試験は免疫の働きの解析や安全性を確認するのみで十分な場合があるとしています。
PMDAはことし9月、新型コロナウイルスのワクチンを審査する際の考え方を公表しています。
それによりますと、有効性を評価するために、
▼ウイルスを攻撃する抗体ができることを確認するだけでなく、ウイルスを排除する免疫の細胞の働きについても解析することを求めています。
その上で
▼臨床試験で、ワクチンを投与するグループとワクチンに似せた偽の薬、「偽薬」を投与するグループに分けて比較することで、発症を予防する効果があるかなどを確認する必要があるとしています。
また、安全性については、
▼臨床試験でワクチンを投与してから少なくとも7日目までと28日目までに体に異常が出ないか確認することや、
▼投与後少なくとも1年間は健康状態の確認を続けることなどが必要だとしています。
一方で、海外で大規模な臨床試験が行われ、予防効果が確認されているワクチンについては、国内での臨床試験は免疫の働きの解析や安全性を確認するのみで十分な場合があるとしています。
専門家「歴史に残る偉業 しっかり審査してほしい」
アメリカの製薬大手ファイザーが、国内で、新型コロナウイルスワクチンの承認を申請したことについて、ワクチン開発に詳しい東京大学医科学研究所の石井健教授は「1年以内にこれだけの規模でしっかりとした臨床試験が行われて、ワクチンがみなさんの手に届くのは、現代の科学の成果で、歴史に残る偉業だ」と評価しました。
そして、今後の審査について「ファイザーのワクチンは複数の国で数万人規模で臨床試験を行っていて、その中には、アジア人も入っていて、人種の違いによって特殊な副作用があるという指摘もいまのところない。日本人に接種して本当に大丈夫なのかは今後の議論だが、審査機関は急がば回れの考え方で、しっかり審査してほしい」と指摘しました。
その上で「ワクチンはすぐに手に入るのかなどと期待する声がある一方で、開発のスピードが早すぎて危ないから打つのを待った方がいいのではないかという声も出ている。ワクチンで得られる利益とリスクについて、知っておくことが大切だ」と述べました。
そして、今後の審査について「ファイザーのワクチンは複数の国で数万人規模で臨床試験を行っていて、その中には、アジア人も入っていて、人種の違いによって特殊な副作用があるという指摘もいまのところない。日本人に接種して本当に大丈夫なのかは今後の議論だが、審査機関は急がば回れの考え方で、しっかり審査してほしい」と指摘しました。
その上で「ワクチンはすぐに手に入るのかなどと期待する声がある一方で、開発のスピードが早すぎて危ないから打つのを待った方がいいのではないかという声も出ている。ワクチンで得られる利益とリスクについて、知っておくことが大切だ」と述べました。
ワクチンの保管と流通は?
国は、来年前半までに国民全員に提供できる数のワクチンを確保することを目指し、欧米の製薬会社3社との間で開発に成功した場合に供給を受ける契約などを結んでいます。
厚生労働省によりますと、今回、承認申請が行われたファイザーのワクチンを保管するには、マイナス75度前後で冷凍する必要があります。
このため、国内の倉庫などで保管できるよう超低温冷凍庫=ディープフリーザーをおよそ3000台確保し、市町村の人口などに応じて公平に割りあてる方針です。
また、医療機関などでも、▽保冷用のボックスとドライアイスを使えば10日間程度、▽冷蔵庫に移したあとは5日間程度保管できるということです。
このため、国はドライアイスを調達して医療機関などに供給することを検討しています。
厚生労働省によりますと、今回、承認申請が行われたファイザーのワクチンを保管するには、マイナス75度前後で冷凍する必要があります。
このため、国内の倉庫などで保管できるよう超低温冷凍庫=ディープフリーザーをおよそ3000台確保し、市町村の人口などに応じて公平に割りあてる方針です。
また、医療機関などでも、▽保冷用のボックスとドライアイスを使えば10日間程度、▽冷蔵庫に移したあとは5日間程度保管できるということです。
このため、国はドライアイスを調達して医療機関などに供給することを検討しています。
ファイザーは「mRNAワクチン」

ファイザーが承認を申請したワクチンは、「mRNAワクチン」と呼ばれるこれまでになかった全く新しいタイプのワクチンです。
このワクチンでは新型コロナウイルスそのものではなく、ウイルスの遺伝情報を伝達する物質、「mRNA」を人工的に作って注射で投与します。
このワクチンを投与すると、体の中で「スパイクたんぱく質」と呼ばれるウイルスの表面にある突起の部分が作られます。
スパイクたんぱく質を目印に、免疫の働きによって新型コロナウイルスに対応する抗体が作られ、ウイルスが体内に侵入した際、抗体が攻撃して感染を防ぐ仕組みです。
mRNAを医薬品に活用するアイデアはアメリカのウィスコンシン大学のグループが1990年に発表した論文で示されていて、当初は遺伝子治療の一環として研究されていました。
特にこの数年、mRNAを生成する技術や安定させる技術などが進んだことで医薬品としての実用化に向けて注目が高まっていました。
また、mRNAを使ったワクチンは、カギとなるmRNAを変えることでほかのウイルスにも応用することができるとみられ、ワクチンの考え方を大きく変える可能性があるとされています。
一方で、mRNAワクチンをはじめ、新型コロナウイルスで開発が進む遺伝情報を使ったワクチンは、これまで実用化されたことのない全く新しい技術となることから、実際に多くの人に使用した場合の効果や副反応については慎重に判断する必要があるという指摘も出ています。
このワクチンでは新型コロナウイルスそのものではなく、ウイルスの遺伝情報を伝達する物質、「mRNA」を人工的に作って注射で投与します。
このワクチンを投与すると、体の中で「スパイクたんぱく質」と呼ばれるウイルスの表面にある突起の部分が作られます。
スパイクたんぱく質を目印に、免疫の働きによって新型コロナウイルスに対応する抗体が作られ、ウイルスが体内に侵入した際、抗体が攻撃して感染を防ぐ仕組みです。
mRNAを医薬品に活用するアイデアはアメリカのウィスコンシン大学のグループが1990年に発表した論文で示されていて、当初は遺伝子治療の一環として研究されていました。
特にこの数年、mRNAを生成する技術や安定させる技術などが進んだことで医薬品としての実用化に向けて注目が高まっていました。
また、mRNAを使ったワクチンは、カギとなるmRNAを変えることでほかのウイルスにも応用することができるとみられ、ワクチンの考え方を大きく変える可能性があるとされています。
一方で、mRNAワクチンをはじめ、新型コロナウイルスで開発が進む遺伝情報を使ったワクチンは、これまで実用化されたことのない全く新しい技術となることから、実際に多くの人に使用した場合の効果や副反応については慎重に判断する必要があるという指摘も出ています。
ファイザー 開発の経緯

アメリカの製薬大手、ファイザーは、ドイツの企業、ビオンテックとともに、mRNAを使った新型コロナウイルスのワクチン開発を進めてきました。
トランプ政権が進めた新型コロナウイルスワクチンを早く供給するための開発計画、「ワープ・スピード作戦」からは一定の距離を置いて開発を進めてきたとされています。
ファイザーは、感染者が多いアメリカやブラジルなどで臨床試験を行い、先月には、4万人を超える人を対象にした大規模な臨床試験で「90%を超える予防効果がある」とする暫定的な結果を発表しました。
この後に発表された詳しい結果を記した論文によりますと、
▼ワクチンを接種した2万人あまりのうち、接種後7日目以降に新型コロナウイルスに感染したのは8人だったのに対し、
▼「偽薬」と呼ばれるワクチンに似せた偽の薬の接種を受けた2万人あまりでは162人が感染したということで、ワクチンによる予防効果は95%だとしています。
こうした結果を受けて、今月2日に世界で初めてイギリスでワクチンが承認され、8日に接種が始まったほか、アメリカでも11日に緊急使用の許可が出され14日に接種が始まりました。
一方で、副反応の報告も出ていて、
▼イギリスでは、接種を受けた2人が激しいアレルギー反応、「アナフィラキシー」のような症状を示したほか、
▼アメリカでも、接種を受けたアラスカ州の医療従事者が「アナフィラキシー」のような症状を示したということです。
イギリスの2人は過去にアレルギー反応が出たことがあった一方、アメリカの医療従事者は過去にはアレルギー反応が出たことがなかったということです。
イギリスの規制当局は、過去に同じような症状が出たことのある人は接種しないよう、予防的な措置としての勧告を出したほか、アメリカCDC=疾病対策センターはワクチンに含まれる成分にアレルギー反応を示した経験がある人は、接種しないことなどを指示しています。
ファイザーの論文や発表によりますと、最終段階の臨床試験ではワクチンの接種後に、
▼けん怠感が出た人が16歳から55歳までの59%、56歳以上では51%いて、
▼頭痛は55歳までの52%、56歳以上では39%に出たということですが、多くはすぐに症状が治まったということです。
また、比較的重い副反応としてけん怠感を訴えた人が3.8%、頭痛を訴えた人が2.0%いたということです。
会社は「重大な安全性の懸念は報告されなかった」としています。
トランプ政権が進めた新型コロナウイルスワクチンを早く供給するための開発計画、「ワープ・スピード作戦」からは一定の距離を置いて開発を進めてきたとされています。
ファイザーは、感染者が多いアメリカやブラジルなどで臨床試験を行い、先月には、4万人を超える人を対象にした大規模な臨床試験で「90%を超える予防効果がある」とする暫定的な結果を発表しました。
この後に発表された詳しい結果を記した論文によりますと、
▼ワクチンを接種した2万人あまりのうち、接種後7日目以降に新型コロナウイルスに感染したのは8人だったのに対し、
▼「偽薬」と呼ばれるワクチンに似せた偽の薬の接種を受けた2万人あまりでは162人が感染したということで、ワクチンによる予防効果は95%だとしています。
こうした結果を受けて、今月2日に世界で初めてイギリスでワクチンが承認され、8日に接種が始まったほか、アメリカでも11日に緊急使用の許可が出され14日に接種が始まりました。
一方で、副反応の報告も出ていて、
▼イギリスでは、接種を受けた2人が激しいアレルギー反応、「アナフィラキシー」のような症状を示したほか、
▼アメリカでも、接種を受けたアラスカ州の医療従事者が「アナフィラキシー」のような症状を示したということです。
イギリスの2人は過去にアレルギー反応が出たことがあった一方、アメリカの医療従事者は過去にはアレルギー反応が出たことがなかったということです。
イギリスの規制当局は、過去に同じような症状が出たことのある人は接種しないよう、予防的な措置としての勧告を出したほか、アメリカCDC=疾病対策センターはワクチンに含まれる成分にアレルギー反応を示した経験がある人は、接種しないことなどを指示しています。
ファイザーの論文や発表によりますと、最終段階の臨床試験ではワクチンの接種後に、
▼けん怠感が出た人が16歳から55歳までの59%、56歳以上では51%いて、
▼頭痛は55歳までの52%、56歳以上では39%に出たということですが、多くはすぐに症状が治まったということです。
また、比較的重い副反応としてけん怠感を訴えた人が3.8%、頭痛を訴えた人が2.0%いたということです。
会社は「重大な安全性の懸念は報告されなかった」としています。
世界の承認・許可状況
各国の保健当局などによりますと、アメリカの製薬大手ファイザーとドイツの企業ビオンテックが開発した新型コロナウイルスのワクチンは、これまでに
▼イギリス、
▼バーレーン、
▼カナダ、
▼サウジアラビア、
▼メキシコ、
▼アメリカ、
▼シンガポール、
▼チリの、
少なくとも8つの国で承認、または緊急使用が許可されています。
▼イギリス、
▼バーレーン、
▼カナダ、
▼サウジアラビア、
▼メキシコ、
▼アメリカ、
▼シンガポール、
▼チリの、
少なくとも8つの国で承認、または緊急使用が許可されています。
国や地域ごとの確保状況
世界では、ファイザーとビオンテックが開発したワクチンを確保する動きが広がっています。
国や地域ごとのワクチンの確保状況を調べているアメリカのデューク大学のまとめによりますと、今月11日の時点で、
▼EU=ヨーロッパ連合が3億回分、
▼日本が1億2000万回分、
▼アメリカと▼中国がそれぞれ1億回分、
▼イギリスが4000万回分、
▼メキシコが3440万回分、
▼韓国と▼カナダがそれぞれ2000万回分、
▼マレーシアが1280万回分、
▼オーストラリアと▼チリ、▼それに香港がそれぞれ1000万回分、▼ペルーが990万回分、
▼イスラエルが800万回分、
▼コスタリカがおよそ300万回分、
▼スイスと▼パナマがそれぞれ300万回分、
▼エクアドルが200万回分、
▼ニュージーランドが150万回分、
▼クウェートが100万回分などとなっています。
国や地域ごとのワクチンの確保状況を調べているアメリカのデューク大学のまとめによりますと、今月11日の時点で、
▼EU=ヨーロッパ連合が3億回分、
▼日本が1億2000万回分、
▼アメリカと▼中国がそれぞれ1億回分、
▼イギリスが4000万回分、
▼メキシコが3440万回分、
▼韓国と▼カナダがそれぞれ2000万回分、
▼マレーシアが1280万回分、
▼オーストラリアと▼チリ、▼それに香港がそれぞれ1000万回分、▼ペルーが990万回分、
▼イスラエルが800万回分、
▼コスタリカがおよそ300万回分、
▼スイスと▼パナマがそれぞれ300万回分、
▼エクアドルが200万回分、
▼ニュージーランドが150万回分、
▼クウェートが100万回分などとなっています。
ワクチン開発 日本勢の進捗は

新型コロナウイルスのワクチン開発は日本国内でも進められていて、国産のワクチンとしてはこれまでに2社が、実際に人に投与して安全性などを確認する臨床試験を始めています。
アンジェス
このうち、大阪にあるバイオベンチャー企業のアンジェスは、国産ワクチンとしては最も早い6月に臨床試験を始め、今月には対象者を500人に増やして臨床試験を続けています。
この会社は、ウイルスそのものではなく、遺伝子を使ったワクチンの一種、「DNAワクチン」を開発していて、投与することで体の中でウイルスを攻撃する抗体を作る仕組みです。
この会社は、ウイルスそのものではなく、遺伝子を使ったワクチンの一種、「DNAワクチン」を開発していて、投与することで体の中でウイルスを攻撃する抗体を作る仕組みです。
塩野義製薬

また、大阪に本社がある製薬大手、塩野義製薬は今月16日、214人を対象に臨床試験を始めました。
開発しているのは、「組み換えたんぱく質ワクチン」というタイプで、遺伝子組み換え技術を使ってウイルスのたんぱく質の一部だけを人工的に作って投与し、体の中で抗体を作り出します。
開発しているのは、「組み換えたんぱく質ワクチン」というタイプで、遺伝子組み換え技術を使ってウイルスのたんぱく質の一部だけを人工的に作って投与し、体の中で抗体を作り出します。
国内での開発課題も
ただ、日本で臨床試験を進める上では課題も指摘されています。
日本は、欧米や南米などと比べると感染者の数が少なく、臨床試験に参加した人が感染する可能性は各国に比べると低いため、ワクチンの効果を確かめるのは難しいと指摘されています。
また今後、海外メーカーのワクチンが国内で広く接種されるようになると、感染者の数がさらに少なくなったり、多くの人が免疫を持ついわゆる「集団免疫」の状態に近づいたりして、臨床試験で予防効果を確認する難しさが増すのではないかという指摘もあります。
このため、国内で医薬品の審査を行うPMDA=医薬品医療機器総合機構は、国内で少人数を対象に行う初期段階の臨床試験を終えたあとは、海外で大規模な臨床試験を行うことも選択肢だとしています。
日本は、欧米や南米などと比べると感染者の数が少なく、臨床試験に参加した人が感染する可能性は各国に比べると低いため、ワクチンの効果を確かめるのは難しいと指摘されています。
また今後、海外メーカーのワクチンが国内で広く接種されるようになると、感染者の数がさらに少なくなったり、多くの人が免疫を持ついわゆる「集団免疫」の状態に近づいたりして、臨床試験で予防効果を確認する難しさが増すのではないかという指摘もあります。
このため、国内で医薬品の審査を行うPMDA=医薬品医療機器総合機構は、国内で少人数を対象に行う初期段階の臨床試験を終えたあとは、海外で大規模な臨床試験を行うことも選択肢だとしています。
国内 他にも開発中のワクチン
このほか、臨床試験には至っていないものの国内でもさまざまなタイプのワクチンの開発が進められています。
このうち、
▼ワクチンメーカーのKMバイオロジクスは、新型コロナウイルスを処理して毒性をなくしたものを投与する「不活化ワクチン」、
▼製薬大手の第一三共は、ファイザーなどと同様の仕組みの「mRNAワクチン」、そして、
▼バイオベンチャー企業のIDファーマがウイルスの遺伝子の一部を別の無害なウイルスに組み込んで投与する「ウイルスベクターワクチン」の開発を進めています。
このうち、
▼ワクチンメーカーのKMバイオロジクスは、新型コロナウイルスを処理して毒性をなくしたものを投与する「不活化ワクチン」、
▼製薬大手の第一三共は、ファイザーなどと同様の仕組みの「mRNAワクチン」、そして、
▼バイオベンチャー企業のIDファーマがウイルスの遺伝子の一部を別の無害なウイルスに組み込んで投与する「ウイルスベクターワクチン」の開発を進めています。


コメント